W tym artykule znajdziesz najważniejsze informacje oraz wzory termodynamiki. Termodynamika to dział fizyki, zajmujący się przemianami energii w zjawiskach cieplnych. Termodynamika stara się odpowiedzieć na pytania jak zmieniają się własności ciał takie jak temperatura, stan skupienia, objętość w wyniku przepływu energii (dostarczania lub odbierania energii).
Tematy z działu: TERMODYNAMIKA
Temperatura | Skale temperatur | Energia wewnętrzna | Przepływ energii (ciepło) | Jednostka ciepła: dżul | Pierwsza zasada termodynamiki | Przewodnictwo cieplne | Zjawisko konwekcji | Ciepło właściwe | Zmiany stanów skupienia | Topnienie i krzepnięcie | Parowanie i skraplanie
Najważniejsze wzory termodynamiki:
- Wzór na I zasadę termodynamiki
- Wzór na energię potrzebną do ogrzania ciała
- Wzór na ciepło pobrane poczas topnienia
- Wzór na ciepło oddane podczas krzepnięcia
- Wzór na energię pobraną podczas parowania cieczy w temperaturze wrzenia
- Wzór na energię oddaną podczas skraplania pary
1. Energia wewnętrzna
Każde ciało posiada pewną energię wewnętrzną. Na tę formę energii składa się energia kinetyczna poszczególnych cząsteczek związaną z ich chaotycznym ruchem i energia potencjalnego oddziaływania cząsteczek. Czytaj dalej →
Wzrost temperatury ciała jest związany ze wzrostem średniej energii kinetycznej cząsteczek.
2. Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki głosi, że energię wewnętrzną możemy zmienić przez wykonanie nad ciałem pracy lub przekazanie ciepła. Czytaj dalej
\large \Delta E_w = W + Q
Gdzie: \Delta E_w – zmiana energii wewnętrznej, W – praca, Q – ciepło
Zobacz przykłady, rozwiązania zadań oraz objaśnienie I zasady termodynamiki
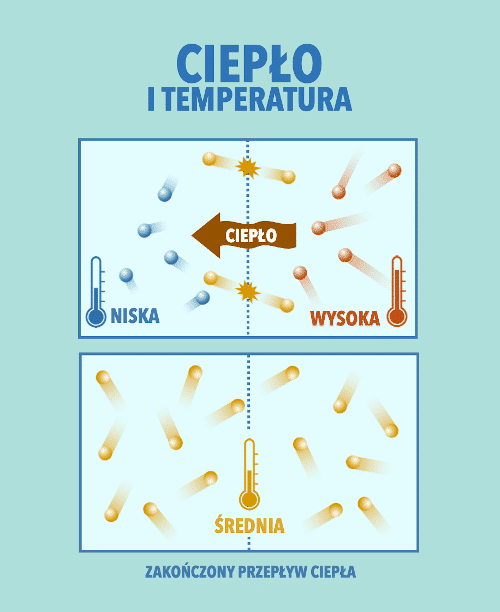
3. Cieplny przepływ energii
Cieplny przepływ energii (ciepło) polega na przekazywaniu sobie energii między cząsteczkami ciała o wyższej temperaturze, a cząsteczkami ciała o niższej temperaturze. Przekazywanie ciepła trwa do chwili wyrównania temperatur. Czytaj dalej →
Jednostką ciepła w układzie SI jest dżul (J).
Sposoby przekazywania ciepła to:
4. Ciepło właściwe
Ciepłem właściwym nazywamy ilość energii potrzebnej do ogrzania 1 kg substancji o 1°C.
Energię potrzebną do ogrzania ciała o masie m obliczmy ze wzoru:
\large Q = m \cdot c \cdot \Delta t
Gdzie: Q – ciepło, m – masa, c – ciepło właściwe, \Delta t – zmiana temperatury
Ciepło właściwe wody wynosi około 4200 J/kg°C.
5. Topnienie ciał krystalicznych
- Topnienie ciał krystalicznych zachodzi w stałej temperaturze.
- Temperatura topnienia jest równa temperaturze krzepnięcia
- Ciało podczas topnienia pobiera, a podczas krzepnięcia oddaje energię do otoczenia.
- Ciepło topnienia jest to ilość energii jaką należy dostarczyć do 1 kg substancji, aby stopić go w temperaturze topnienia.
Energię (ciepło) pobrane w czasie topnienia (lub oddana w czasie krzepnięcia) obliczmy ze wzoru:
\large Q = m \cdot c_t
Gdzie: Q – energia (ciepło), m – masa, c_t – ciepło topnienia
6. Parowanie i skraplanie
- Podczas parowania ciecz pobiera energię z otoczenia.
- Podczas skraplania para oddaje energie pobraną w czasie parowania.
- Ciepło parowania w temperaturze wrzenia jest to ilość energii jaką należy dostarczyć do 1 kg cieczy, aby zamienić ją na parę w temperaturze wrzenia.
Energia pobrana podczas parowania cieczy w temperaturze wrzenia (lub oddana podczas skraplania pary) wyraża się wzorem:
Q = m \cdot c_p
Gdzie: Q – energia (ciepło), m – masa, c_t – ciepło parowania
7. Zasada bilansu cieplnego:
Jeżeli dwa ciała są izolowane cieplnie od otoczenia, to energia oddana przez ciało o wyższej temperaturze jest równa energii pobranej przez ciało o niższej temperaturze.
PRZYDATNY ARTYKUŁ? Udostępnij link innym:

Następny temat:
Temperatura
Pozostałe tematy z działu: TERMODYNAMIKA
Temperatura | Skale temperatur | Energia wewnętrzna | Przepływ energii (ciepło) | Jednostka ciepła: dżul | Pierwsza zasada termodynamiki | Przewodnictwo cieplne | Zjawisko konwekcji | Ciepło właściwe | Zmiany stanów skupienia | Topnienie i krzepnięcie | Parowanie i skraplanie